N6-甲基腺嘌呤(N6-methyladenosine,m6A)是真核生物mRNA中最豐富的内部修飾,在調節RNA功能和代謝方面起着關鍵作用。METTL3-METTL14甲基轉移酶複合物是負責催化m6A的關鍵元件,包括催化亞基METTL3和輔助亞基METTL14,以及多個支架蛋白WTAP、ZC3H13和RBM15等。METTL3作為METTL3/14甲基轉移酶複合物中重要的催化核心,已被鑒定為多種腫瘤潛在的治療靶點。
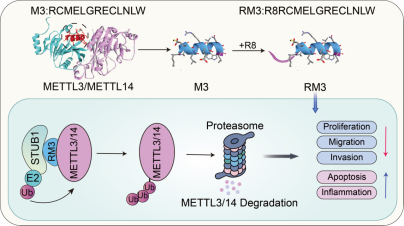
近日,2003网站太阳集团生命交叉研究院史俊峰課題組在Angewandte Chemie International Edition發表了一篇題為Peptide degrader-based targeting of METTL3/14 improves immunotherapy response in cutaneous melanoma的研究論文。該研究驗證了METTL3在惡性黑色素瘤發生發展中的促進作用,并對課題組前期開發的靶向METTL3的多肽抑制劑RM3的作用機制進行了進一步挖掘。結果表明RM3能夠招募E3連接酶STUB1降解并通過蛋白酶體途徑降解METTL3,并重塑腫瘤微環境以增強腫瘤對免疫檢查點抑制劑的應答。後續一系列實驗也證實RM3不僅能夠有效抑制黑色素瘤生長,而且能夠改善免疫治療的效果,并具有良好的安全性。

該研究首先構建了METTL3穩定敲低的黑色素瘤細胞系,通過EdU摻入,Transwell和細胞成球等實驗,證實了METTL3能夠促進黑色素瘤細胞的增殖,遷移,侵襲和自我更新能力;同時荷瘤實驗進一步證實METTL3能夠促進黑色素瘤的體内生長。上述結果表明METTL3在黑色素瘤中發揮促癌功能。
在此基礎上,利用親和力測定和多肽pull down等實驗,證實了RM3能夠有效具有靶向METTL3。同時通過細胞毒性和Western blot實驗,證實RM3能夠有效降低黑色素瘤細胞活性,并誘導METTL3和METTL14的降解。為了闡明RM3誘導METTL3/14降解的潛在機制,作者進行了蛋白半衰期實驗,發現RM3能夠縮短METTL3半衰期;進一步通過網站預測,IP實驗和泛素化實驗,證實RM3的處理能夠招募更多的STUB1,提高METTL3與METTL14的泛素化水平進而誘導其降解。與此同時,RNA-seq數據表明RM3的處理可能重塑腫瘤微環境中的炎性反應,增強腫瘤對免疫檢查點抑制劑治療的反答。
接下來,體外細胞實驗表明對RM3處理後黑色素瘤細胞的增殖,遷移和侵襲能力降低,并誘導黑色素瘤細胞的凋亡。而且小鼠荷瘤模型也證明RM3能夠有效抑制黑色素瘤的體内生長,并具有較好的安全性。更重要的是,RM3與aPD-1的聯合治療組的治療效果更優于單藥治療組,表明RM3能夠提高免疫治療的應答反應。
綜上,該研究不僅證實METTL3在黑色素瘤中的緻癌作用,而且表明RM3作為METTL3的多肽降解劑,可以作為一種有前景的腫瘤治療策略和聯合治療選擇。
2003网站太阳集团博士生韓宏和李增輝為本論文的共同第一作者,史俊峰教授為通訊作者。課題組在多肽藥物領域持續發力,近3年在Nat.Commun(2024)、Angew Chem (2022, 2024, 2024)、ACS Nano (2023)、J. Control. Release (2024) 等國際期刊發表高水平論文16篇,申請或獲批專利15個。課題組經費充足,歡迎有志于多肽研究的青年才俊加入課題組從事博士後研究。